铝阳极氧化膜形成过程中离子迁移的规律及对膜形态的影响
铝阳极氧化膜形成过程中离子迁移的
规律及对膜形态的影响
徐 源 ,G. E. Thompson G. C. Wood
(北京钢铁学院腐蚀中心)(英国曼彻斯特大学理工学院腐蚀与保护中心)
摘要: 用透射电镜、标记原子及等离子体发射光谱定量分析等技术,研究了铝阳极氧化膜生长过程中离子迁移分数及其对膜形态的影响。实验发现,在膜形成过程中,铝和含氧离子沿相反方向漂移穿过膜。在同一电解质溶液中,铝离子的真实迁移分数基本恒定。当电流密度超过某一临界值时,部份铝离子在膜与溶液界面处形成新膜物质,膜的形态为壁垒型。而当电流密度小于临界电流密度时,全部铝离子均进入溶液,这时膜完全由含氧离子在膜与基体界面处形成,由于溶液对膜外表面的侵蚀,形成的膜为多孔型。推导了膜生长效率的理论表达式;表观迁移分数的关系式,用溶解-沉积理论解释了铝离子在膜与溶液界面处形成新膜物质的机理。
一、前言
铝阳极氧化膜分为壁垒型及多孔型两类。过去对这两种膜的研究是分别进行的。流行的观点认为:在近中性溶液中形成壁垒型膜;在酸性溶液中形成多孔型膜。但也有在中性溶液中形成多孔型膜及在酸性溶液中形成壁垒型膜的报导。因而,还没有能统一解释膜的形态变化规律的理论。
本文报导了作者对铝阳极氧化膜形成过程中离子迁移规律的系统研究;确立了电流密度与膜形态的关系,首次提出了临界电流密度的概念;从理论上解释了膜的形态与离子迁移分数的关系。并用溶解-沉积理论解释了在膜与溶液界面上新膜物质的形成过程,提出了相应的数学模型。
二、实验方法
试样处理方法,实验步骤及为测定迁移分数所采用的标记原子技术、超薄切片技术请参见文献,本工作中,为便于分析进入溶液的铝离子量,阳极氧化在体积为10ml的小型电解池中进行,用铂箔作环形阴极,电解池置于恒温槽内。阳极氧化后,用等离子体原子发射光谱定量分析溶液中铝的含量。
三、铝阳极氧化膜生长的电流效率
在一定体积(V)的电解质溶液中,阳极氧化时间为t,电流强度为I,溶液中的铝离子浓度为C。假设:
1.在阳极氧化过程中,没有电子电导,只有离子电导(铝氧化膜禁带宽度为5.73eV,可看成是电子电导绝缘体,同时忽略膜极薄时的量子隧道效应)。阳极氧化的电流,全部是由铝离子和含氧离子携带的。
2.铝离子均为三价
3.无消耗电荷的副反应,阳极氧化的电流全部用于膜的形成或被铝离子带入溶液。
则阳极氧化时消耗的总电量Q为
Q= It
阳极氧化时进入溶液的铝离子所带电量Q1为
![]()
F为法拉弟常,数A为铝的克原子量,A= 26.98克,于是,阳极氧化中用于形成膜的电量Qf为
Qf=Q- Q1
膜生长的电流效率η为 ![]()
代入本研究中各参数的相应值(V=10-21)可得到:
![]()
由实验测得的C(g/l),I(A),t(sec.)就可算出膜生长的电流效率。本研究工作中,测量的精度约为4%,个别的可达0.1%。
四、实验结果
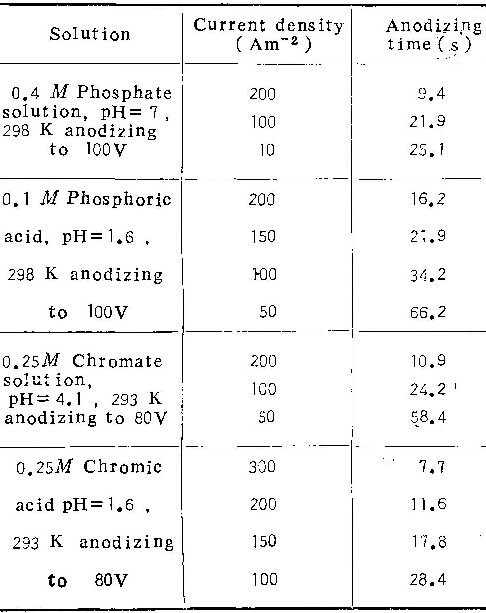
1.在铬酸中形成的氧化膜
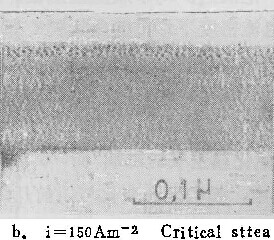
图1为在温度293K的0.25M铬酸溶液中于不同电流密度下形成的膜的超薄切片电镜照片。样品中均注入了标记氙原子,阳极氧化最终电压为80V。表1列出了膜生长的电流效率及铝离子的表观迁移分数。(关于表中真实迁移分数的计算,见本文讨论部份)。在大电流密度时( i= 150Am-2),膜为壁垒型(图1a)。标记原子层上方的膜是铝离子迁移到膜与溶液的界面处形成的,标记原子层下方则为含氧离子迁移到膜与基体界面处形成的。上层膜厚与总膜厚之比,定义为铝离子的表观迁移分数,约为0.22。阳极氧化后,分析溶液中的铝离子,按(1)式算出电流效率为66%。



![]()
![]()
![]()
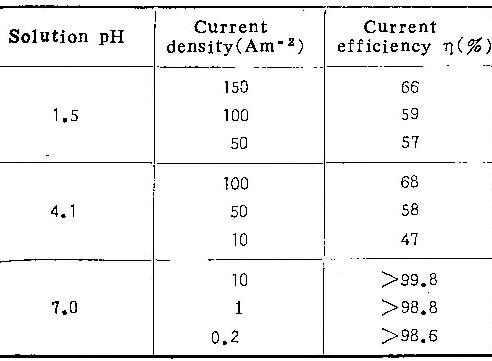
当i下降至约100Am-2时(图1b),虽然膜仍为壁垒型,但标记氙原子位于膜的最外表面,且溶液中可检测到较多的铝离子,电流效率降至59%。表明膜全部由含氧离子形成,向外迁移的铝离子完全进入溶液。
当i进一步减少到50Am-2时,标记氙原子也位于膜的表面(图1c),说明铝离子对膜的生长没有贡献。但溶液中有更多的铝存在。电流效率进一步降至57%。由图可见,膜的外表面受到电解质溶液的侵蚀,产生了不少裂纹。实际上,这种膜已属多孔型。溶液中的铝,一部份来自向外迁移的铝离子,另一部份则是阳极氧化膜受侵蚀溶解部份所含的铝离子。由上可见,随电流密度下降,膜的形态由壁垒型转变为多孔型。这里存在着一个临界电流密度ic,在i大于ic时,形成壁垒型膜,而当i小于ic时,形成多孔型膜。


![]()
![]()
2.溶液酸度值对阳极氧化膜生长的影响
图2为在pH= 4.1的0.25M铬酸铵溶液中形成的阳极氧化膜。类似于在铬酸铵溶液中的情况,随电流密度的降低,膜的形态由壁垒型转变为多孔型。临界电流密度ic= 50 Am-2。另外,由表1可看出:在相同的电流密度下,在pH= 4.1的溶液中,电流效率较高,铝离子的表观迁移分数较大。
图3为pH=7.0的0.25M铬酸铵溶液中形成的膜的形态。由表1可见,此种情况下的电流效率很高。在i= 10~0.2Am-2范围内,均形成壁垒型膜。为确定在这种溶液中可否形成多孔型膜,我们首先在10Am-2电流密度下形成壁垒型膜(如图3a),最终阳极氧化电压为80伏,任电流衰减。经3小时后,电流稳定在0.03Am-2。这时膜的形态如图3a所示,已变为多孔型。这就说明:在中性铬酸盐溶液中,也可以形成壁垒型及多孔型两类膜,形态转变的临界电流密度ic在0.2Am-2以下(图3c),0.03Am-2以上(图3d)。




![]()
![]()
3.温度及溶液浓度对阳极氧化膜生长的影响
在温度为333K的0.25M铬酸中,膜的形态变化与以前几组照片类似。由表2可见,溶液温度升高后,在同样电流密度下,电流效率η下降,ic值则显著增加(由293K之100Am-2增至333K之约400Am-2)。
表3为在温度293K的1M铬酸溶液中的实验结果。比较表1可知,铬酸浓度对η与ic值影响不显著。



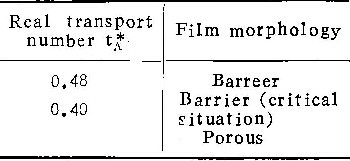

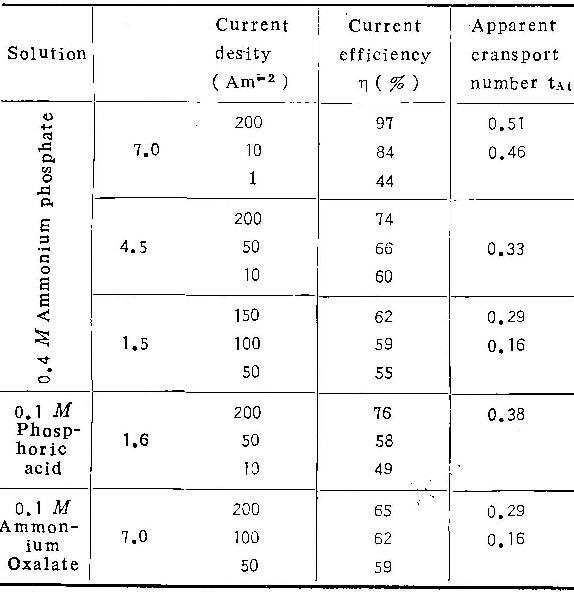
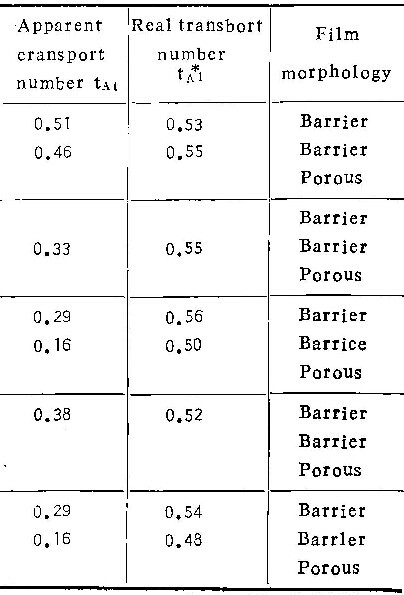
4.不同电解质溶液对铝阳极氧化的影响
在0.1M铬酸、0.4M中性草酸铵及0.1M磷酸铵溶液中的实验结果列于表4。电镜观察类似于在铬酸盐溶液的情况,即随电流密度下降,阳极氧化膜的形态,也从壁垒型转变为多孔型,电流效率逐渐下降。由表4看出,在中性草酸铵溶液中,η值远远低于在中性磷酸铵或中性铬酸铵中者。且在草酸铵溶液中的ic值(≤100Am-2)也远远大于在中性铬酸铵(0.03Am-2~0.2Am-2)及中性磷酸铵(1 Am-2~10Am-2)中之值。至于磷酸铵溶液的酸度值对膜生长影响的规律,与在铬酸铵中一样。
以上实验结果均表明,在所研究的溶液中,均有一个临界电流密度值。阳极氧化电流密度高于该值,形成壁垒型膜;低于该值则形成多孔型膜。图4中的照片即为在铬酸及磷酸铵溶液中低于临界电流密度值时,形成的多孔型膜的形态。
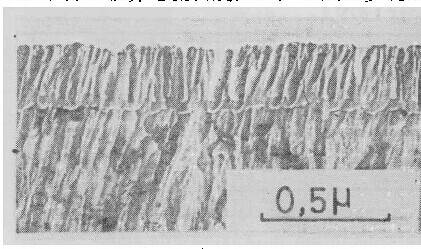

![]()
![]()
![]()
![]()
五、讨论
1.铝阳极氧化膜的生长模型
上述所有实验条件下标记氙原子层下方总有膜物质存在。这就是说含氧离子总是向膜与基体金属界面迁移并在此界面形成新膜物质。另一方面,在形成壁垒型膜时,标记氙原子层上方一般也有膜物质存在。它是由铝离子在膜与溶液界面处形成的。它的存在,表明了铝离子在膜生长过程中向膜外迁移。当电流密度i减小时,外层膜厚度减少。待i
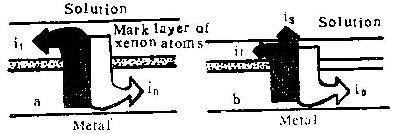
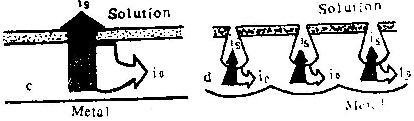
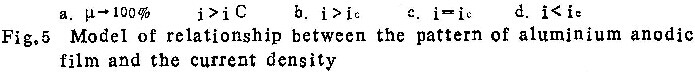
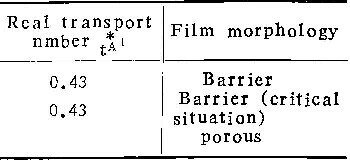
在阳极氧化过程中,含氧离子和铝离子在膜中强电场作用下向相反方向迁移。前者总是在膜与基体的界面上形成新膜物质,后者的情况比较复杂。在很高电流密度下,几乎全部铝离子都在膜与溶液界面上形成膜物质,电流效率接近100%,形成的膜为壁垒型(图5 a;图3 a、3b、3c,表4中性磷酸铵溶液中i=200Am-2时)。当电流密度减小时,向外迁移的铝离子有一部份形成新膜物质,另一部份则进入了溶液,因而η值减小。电流密度越小,形成膜物质的铝离子所占比例也越小,电流效率越低(图5 b)。当i=ic时,所有向外迁移的铝离子均进入溶液。这时,尽管膜仍为壁垒型(图5c、图1b、图2b),却完全是由含氧离子在膜与基体界面处形成的。若电流密度进一步下降,不仅向外迁移的铝离子全部进入溶液,而且膜的外表面受到溶液的侵蚀,形成许多孔洞,膜的形态变为多孔型(图5d、图2c、图3d、图4)。
图5所示模型,揭示了壁垒型膜与多孔型膜的区别在于:前者是由铝离子和含氧离子共同形成的,而后者整个是由含氧离子形成的。
2.铝离子的表观迁移分数与真实迁移分数
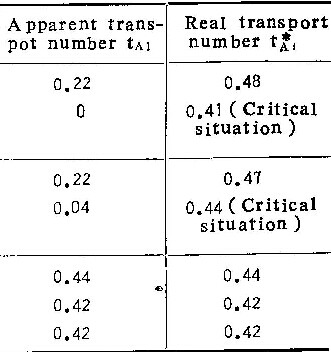
由上述模型可以看出,在多数,情况下,阳极氧化时向外迁移的铝离子总有一部份直接进入溶液而不参与膜的生长。故从标记原子层在膜中的位置测出的铝离子的迁移分数,并不表示在阳极氧化过程中铝离子所携带的电量与氧化过程总电量之比(即铝离子的真实迁移分数,在表1中用tA表示)。因此,我们把直接测得的迁移分数,称为“表观迁移分数”,用tA1表示。
在已知电流效率1的条件下,可以推导出tA1与tA的关系,参见图6。
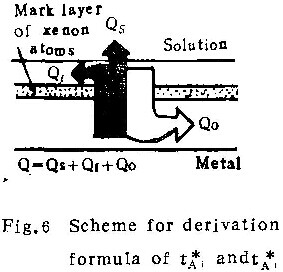
Q——耗的总电量;
QA1——铝离子所携带的总电量;
Qf——形成膜那部份铝离子所携带的电量;
Qs——入溶液的铝离子所带的电量;
Qo——含氧离子所携带的电量。
显然
QA1= Qf+QS
Q= QA1+Qo= Qf+Qs+Q1
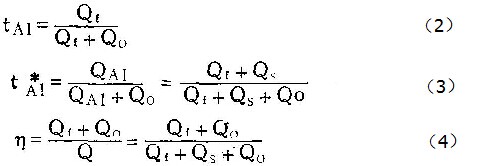
(3)式除以(4)式给出:
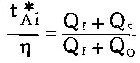
即
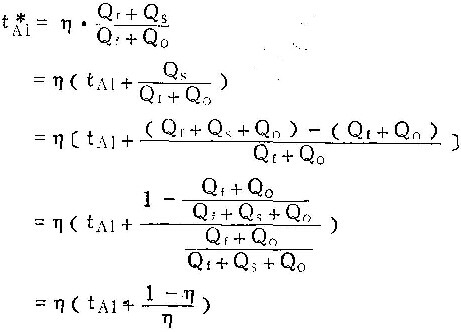
最后可得出:
![]()
按照(5)式,可由实验测得的tAl及η值算出tA1。表1至表5中tA1之值,即按此式算出。
由各表中铝离子的真实迁移分数值可看出,在铬酸铵溶液中,无论溶液浓度、温度或电流密度如何,尽管tA1变化很大,但tA1总是0.44±0.04。同样,在磷酸铵溶液中,tA1总是0.53±0.03。考虑到实验误差,可以认为这些数值是常数。因此可以认为:在同类电解质溶液中阳极氧化时,铝离子所携带的电量分数不随阳极氧化条件而改变。
3.临界电流密度值
临界电流密度可作为判定氧化膜形貌的参数。表5列出本工作所测定的各种条件下的临界电流密度。可以看出:
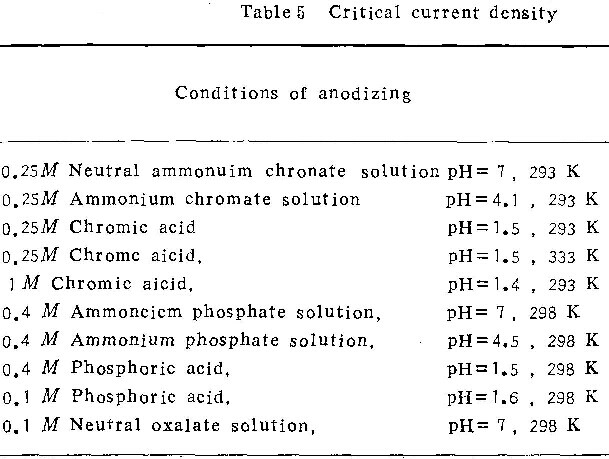
(1)通常人们所说的“形成多孔型膜的电解质”(如磷酸、铬酸、硫酸、草酸)与“形成壁垒型膜的电解质”(如中性磷酸铵、铬酸铵、硼酸等)之间的区别,仅在于其临界电流值大小的不同。前者临界电流密度值较大(如磷酸、铬酸溶液);后者临界电流密度值较小(如中性铬酸铵、中性磷酸铵溶液)。若电流密度足够大,在易于形成多孔型膜的溶液中可形成壁垒型膜。如生产铝电解容器,常用磷酸作电解质。因电流密度高达2000Am-2,远大于临界电流密度值,故生成的膜为壁垒型。另一方面,若电流密度足够小,则在易于形成壁垒型膜的电解质溶液中也可形成多孔型膜。如在中性磷酸铵溶液中,若电流密度较小,则生成多孔型膜(图4a)。
(2)影响临界电流密度值的因素:下列因素对临界电流密度值有影响。
电解质种类。从表5可看出,不同的电解质溶液有不同的临界电流密度。如在中性草酸铵溶液中的临界电流密度(ic= 100Am-2)比在中性磷酸铵(ic=1~10Am-2)及中性铬酸(ic=0.03~0.2Am-2)中大得多。
溶液温度。临界电流密度值随溶液温度的升高而显著增加。如当0.25M的铬酸溶液的温度从293K增至333K时,临界电流密度从100Am-2增至400 Am-2。
溶液的浓度。溶液浓度对临界电流密度的影响较为复杂。在有的溶液如铬酸中,临界电流密度与浓度关系不大。而在另一些溶液如磷酸中,临界电流密度随溶液浓度增加而增加。
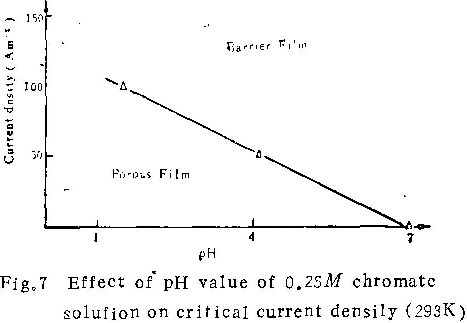
溶液的酸度值。溶液的pH值越高(到pH=7.0为止),临界电流密度越小。图7为在0.25M铬酸铵溶液中临界电流密度与pH值的关系。如果作出不同条件下临界电流密度与pH值的关系图,就可根据阳极氧化条件,断定生成的膜的类型。
4.在膜与溶液界面处膜物质形成的机理
过去认为,在形成壁垒型膜时,铝离子先在膜与溶液界面上全部形成膜,然后膜再部份溶解,因而溶液中含铝离子。但本研究工作说明,进入溶液的铝离子更可能是穿过膜后直接进入溶液的。我们可以用下述铝离子的“溶解——沉积”机制,来解释铝离子部份成膜,部份进入溶液的现象。
(1)阳极氧化一开始,铝离子就在膜中强电场作用下向膜外迁移并全部进入到膜表面的溶液一侧。
(2)进入溶液的铝离子大部份与水分子及电解质离子发生复杂的水合及化学反应,形成多种粒子。它们往往带有电荷。
(3)残留自由铝离子和带电含铝粒子向溶液深处扩散,并形成铝在溶液中的浓度梯度。在溶液与膜的界面处,铝浓度最大;越远离界面,浓度越低。
(4)随着阳极氧化的进行,铝离子不断进入溶液。在膜与溶液界面处,含铝离子浓度迅速提高。
(5)当膜与溶液界面处含铝离子浓度达到某一临界值时,发生沉积反应,形成新膜物质。这些新膜物质一般含有电解质溶液的成份。
(6)阳极氧化继续进行,很快达到动态平衡状态。这时在膜与溶液界面处铝的浓度保持在使沉积反应得以进行的饱和浓度值。膜不断增厚,阳极氧化电压也不断升高。直至氧化过程结束或达到击穿电压。
用上述机制,很容易解释临界电流密度的存在。因为含铝离子不断向外扩散,为保持膜与溶液界面处的一定浓度,必须由从膜中进入溶液的铝离子来补偿。如果铝离子通量太小,不足以使界面处铝离子浓度增加到能发生沉积反应的程度,则在膜与溶液界面处不会生成新膜物质,不能形成壁垒型膜。因此铝离子的通量必须大到足以补偿由于扩散而离开界面的量,与之相应的电流密度,即为临界电流密度。
用“溶解——沉积”机制还很容易解释前面总结的影响临界电流密度的一些因素。不同的电解质溶液中,沉积反应的具体机制不同,所需的临界铝离子浓度不一样,临界电流密度值也就不同。溶液pH值降低,溶度积值提高,从而增加临界电流密度。增加溶液温度,也会提高沉积反应的溶度积,使临界铝离子浓度增加;温度还会提高铝离子扩散速度,二者均陡临界电流密度教值增加。至于酸溶液浓度的影响,呈现较复杂的情况。酸浓度较高时,一方面氢离子活度增大,倾向于增加临界电流密度;而酸根浓度的增加,又会促进沉积反应,即倾向于降低临界电流密度。究竟临界电流密度增加还是减少,取决于上述两个因素中哪一个起主导作用。在铬酸的情况下,两个因素作用基本抵消,故临界电流密度与铬酸浓度关系不大。但在磷酸溶液中,氢离子的影响较大,故在0.4M磷酸溶液中的临界电流密度大于在0.1M磷酸溶液中的值。
5.膜与溶液界面处膜物质形成的数学模型
根据上述成膜机制,在一定简化条件下,可进行半定量的数学处理(图8)
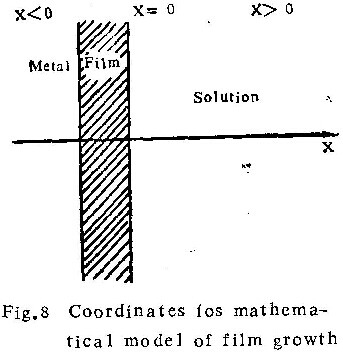
首先,可把溶液看成半无限大介质(X>0),而把样品看成与之相邻的另一个半无限大介质膜与溶液的界面位于X=0处,在恒电流方式下壁垒型膜生长过程中,达到平衡状态时,界面处铝离子的浓度保持在某一常数值Co(临界浓度)。铝离子的通量也是常数(因铝离子的迁移分数是恒定的)。铝离子向溶液深处的迁移,遵从扩散——漂移方程,但因支持电解质浓度很大,故可以不考虑电场的影响,而用扩散方程来描述

C是溶液中铝离子的浓度,D是它的扩散系数。阳极氧化前,溶液中铝离子浓度为零,即初始条件为:
C(x、o)=0 (X>0) (7)
作为近似,可认为一旦阳极氧化开始,马上就可达到平衡状态,即膜与溶液界面处铝离子浓度立即达到临界值Co。由此可得边界条件为:
C(o、t)=Co (t>0) (8)
用拉普拉斯变换法解方程(6)~(8),可得(7)
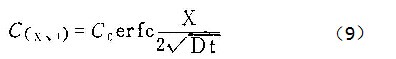
其中:
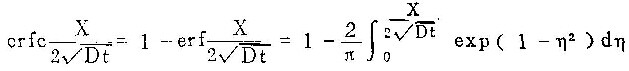
单位时间内从单位表面积阳极进入溶液的铝离子通量为:
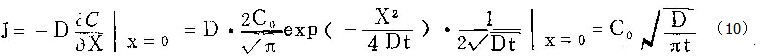
在t=0到t=t时间间隔内,从单位面积进入溶液的铝离子量为:
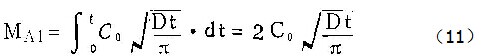
这些铝离子所携带的电荷总量为:
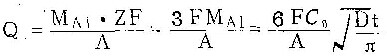
于是,在恒电流密度i的条件下,膜生长的电流效率为:
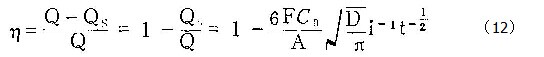
令 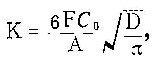
那么( 1a)式可写为:
![]()
(13)式是在恒电流阳极氧化条件下,壁垒型膜生长的电流效率的理论表达式。由K之定义可看出,当电解质溶液条件不变时,K值为-常数,与电流密度无关。表6列出本研究工作几组试验所得出的K值。可见,在实验误差范围内,每种溶液中K值基本一致,与( 13)式预期的结果相符。
![]()

六、结论
1.铝阳极氧化时,铝离子总是穿过膜向膜与溶液界面处迁移。当外加电流密度大于某一临界值——临界电流密度时,部份铝离子在此界面处形成新膜物质,另一部份进入溶液,形成的膜为壁垒型。
2.壁垒型膜生长的电流效率可近似表示为
![]()
式中K为常数,与电流密度无关。i为电流密度,t为时间。
3.壁垒型铝阳极氧化膜生长时,铝离子的真实迁移分数基本为一定值。在铬酸铵溶液中,约为0.44,在磷酸铵溶液中约为0.53。铝离子的真实迁移分数tA1与表观迁移分数的tA1关系为:
![]()
4.临界电流密度值因电解质溶液类别tA1不同而不同;随溶液温度升高而增大;随溶液pH值的升高而降低(到pH= 7.0为止)。
5.铝阳极氧化膜在膜与溶液界面处的生长,可用溶解——沉积理论加以解释。
6.当阳极氧化电流密度值降至临界电流密度以下时,向外迁移的铝离子全部进入溶液而对膜的生长没有贡献。这时膜为多孔型。它全部由含氧离子在膜与基体金属界面处形成。
壁垒型膜与多孔型膜的区别在于:前者是由铝离子与含氧离子在膜的两个界面处共同形成的,而后者仅由含氧离子形成。

