铝阳极氧化的极限厚度
铝阳极氧化的极限厚度
周建生 译;王祝堂 校
一、绪 言
作为装饰或防腐底层的铝阳极氧化膜的厚度一般为3~10微米。另一方面,硬质阳极氧化的膜厚从20~100微米。
过去不应用厚度超过100微米的氧化膜,因而对这种膜的研究很少。但是近来的发展指出,有时需要应用比以往更厚的氧化膜。
许多研究铝阳极氧化的学者认为,铝的阳极氧化膜应该有极限厚度。例如,Nagayama和Diggle等已证明在直流电阳极氧化过程中,由于溶液中的氧化膜发生溶解作用,所以存在着一个极限氧化膜厚度。
根据他们的化学溶解理论,使用高电流密度可形成厚的阳极氧化膜,然而,使用高电流密度阳极氧化时,会引起损坏基体的过熔现象。
我们对阳极氧化烧熔现象的研究以及根据烧熔原理而开发的高速阳极氧化工艺能估算铝阳极氧化膜的极限厚度。
二、烧熔条件
铝在直流电高电流密度阳极氧化时会发生烧熔现象。图1示意了直流电阳极氧化槽液电压的变化与时间的关系和烧熔的发生。在阳极氧化过程中,认真观察槽液电压就可看到烧熔现象的突然出现。因为当烧熔出现时,电压稍微有些下降。
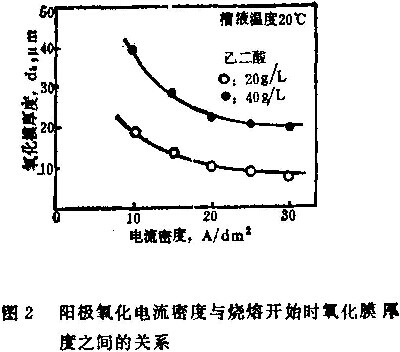
在烧熔开始时,氧化膜的厚度随着电流密度的增大而下降,如图2所示。烧熔开始时,氧化膜厚度和电流密度之间的关系已经被试验所证明,可用公式(1)和(2)表示:
对于乙二酸:
![]()
对于硫酸:
![]()
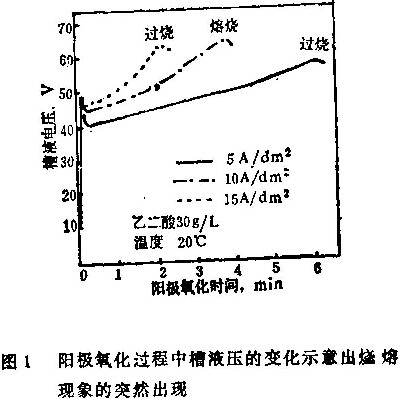
这些关系可用通过阳极氧化膜显微孔隙的离子质量迁移来解释。例如,用乙二酸槽液处理时,由于乙二酸离子进入阻挡层表面的膜内,使显微孔隙底部的乙二酸浓度下降,这不仅会引起槽液电压增大,而且还引起烧熔现象。
阳极氧化膜含有乙二酸,乙二酸是溶液中渗滤到显微孔隙内的。根据这点,阳极氧化过程中,在乙二酸槽液中,就显微孔隙底部乙二酸的物质平衡可得到下列公式。
iβ/PnF= D(Co- Cb)/d (3)
式中 i——电流密度;
β——氧化膜所含有的乙二酸的摩尔分数;
P——氧化膜的显微孔隙率;
n——反应中铝离子的变化系数;
F——法拉弟常数;
Co、Cb——槽液和显微孔隙底部的乙二酸浓度;
d ——阳极氧化膜的厚度;
D——二酸通过显微孔隙的扩散系数。
设显微孔隙底部的乙二酸浓度达到0时,出现烧熔现象,则烧熔刚开始时的氧化膜厚度可用公式(4)表达。这个设想已在我们过去的工作中得到证明。
db=nFCoρD/iβ (4)
考虑到n,F, Co,ρ,D和β是常数,所以公式(4)就变成了公式(1):
db= Bo/i
式中Bo=nFCoρD/β
于是公式(3)可改写为:
Cb= Co -diβ/nFρD (5)
公式(5)表明显微孔隙底部的乙二酸浓度不是随着阳极氧化膜厚度的增加就是随着施加的电流密度的增加而减少。直流电流阳极氧化时,槽液电压随时间而增加的现象得到了解释。
图3示出了阳极氧化过程中,使用循环水内冷的圆铝管作阳极时,槽液电压的变化和击穿现象。
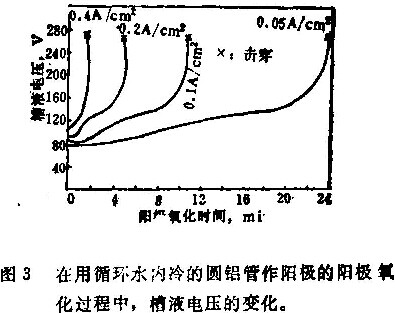
对图1和图3作一番比较可看出,试样上的烧熔现象是由于焦耳热和槽内的不均匀的搅拌所引起的表面温度不均匀造成的。重要的是要注意到公式(1)和(2)中的烧熔常数有不同的值,这取决于槽内搅拌的情况。
公式(2)中硫酸槽液的Bs可看作铝离子的质量迁移。在阳极氧化过程中,铝离子从显微孔隙底部溶解到溶液中。
三、氧化膜最大厚度
在直流电阳极氧化中,最初时电流密度低,阳极氧化膜的厚度随时间增加而加厚;然后,由于氧化膜化学溶解到溶液中,阳极氧化膜厚度达到恒定值。
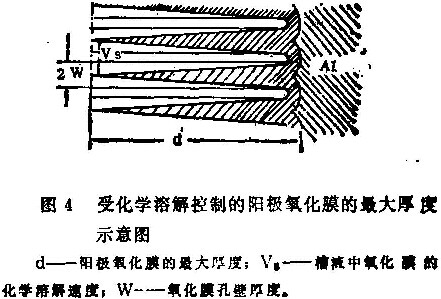
图4是阳极氧化膜的剖面示意图,它达到了最大厚度。设定两显微孔隙间的壁厚(w)是均匀的,氧化膜的恒定化学溶解速度为(Vs),则整个壁完全溶解所需要的时间(ts),可用(6)式表达。
ts= W/Vs (6)
在直流电的作用下,铝表面的氧化膜厚度与阳极氧化电流密度(i)、阳极氧化时间(t)成正比增加,可用公式(7)表示。
d =Kit (7)
由于初期所形成的氧化膜在时间ts内已溶解了,于是最大氧化膜厚度dmax的表达式(8)为:
dmax=Kits (8)
这里K是氧化膜成长常数,其值为0~0.3微米/安培/分米2。
为了在铝表面形成厚的氧化膜,使用高电流密度会引起烧熔现象;所以,施加的电流密度受公式(1)和(2)的限制。因此,联合解公式(7)、 (1)和(2),可得到直流阳极氧化膜的厚度公式:
在乙二酸槽液中:
dm=(KBots)0.5 (9)
im= (Bo/Kts)0.5 (10)
在硫酸槽液中:
dm =Bs0.57(Kts)0.33 (11)
im= (Bs/Kts)0.07 (12)
式中dm是直流阳极氧化膜的最大厚度,im是电流密度。
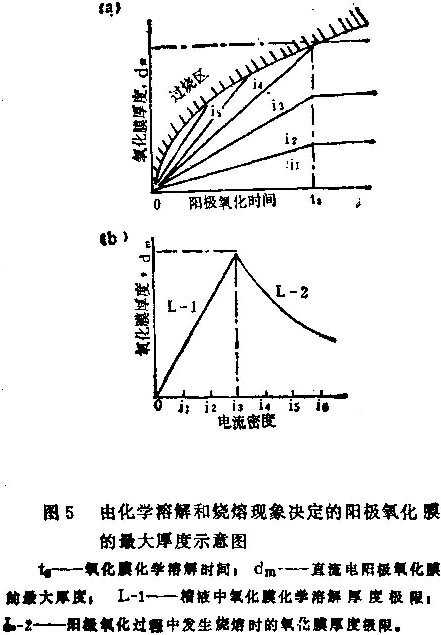
图5是受化学溶解以及烧熔现象控制的氧化膜最大厚度示意图。图5(b)的L-1和L-2分别为化学溶解和烧熔现象所决定的氧化膜厚度。曲线上的交点对应着最大厚度dm。由公式(9)和(12)计算dm和im时,必需通过试验确定ts值。
图6(a)给出了阳极氧化膜在乙二酸槽液中的重量损耗与浸渍时间的关系。图6(b)表示ts值的变化与温度的关系。
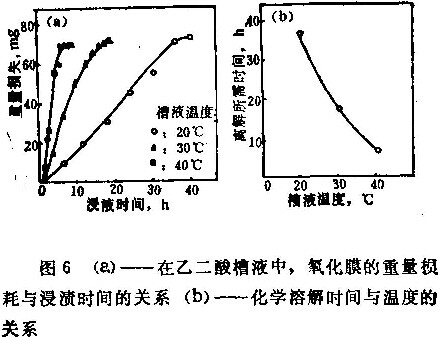
根据图6可知:Bo= 390安培/(分米3·分),K= 0.27微米/安培/分米2,ts=330分,那么在温度为40℃时计算的乙二酸槽液的im和dm值如下:
im=(390/0.27×330)4.5=1.98安培/分米2
dm=(0.27/390×330)0.5=186微米
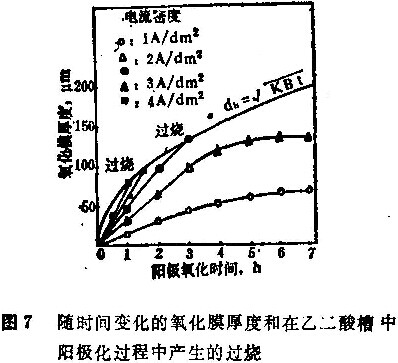
为了证实氧化膜极限厚度的理论,施行了变化电流密度的阳极氧化处理。图7示出了阳极氧化膜的厚度变化与时间的关系,以及在高电流密度时的烧熔现象。在2安培/分米2的最终氧化膜厚度比在1. 98安培/分米2时的理论值186微米要低。
如图8所示(图略),这种偏差是阳极氧化过程中氧化膜表面的粉化现象引起的。这种粉化现象是由胞状孔径不均匀,显微孔隙溶解时间不同造成的。
这些结论从理论上证明了阳极氧化膜有一个最大厚度存在。对于硫酸槽液,采用同样的方法也可以证明氧化膜有一个最大厚度。
四、高速阳极氧化
为了在铝表面上形成厚的氧化膜,必要的是在to时间内通过大的阳极化电流而不产生烧熔现象。为了这个目的,利用公式(1)和(2)所给出的烧熔现象曲线,研究出了高速阳极氧化工艺。
图9是一个高速阳极氧化工艺示意图,图9中曲线B是烧熔临界线,由公式(1)和(2)所决定。如图9中曲线H上的箭头所示,随着时间变化改变阳极氧化电流密度,能够在不出现烧熔现象的情况下获得阳极氧化膜的最高生成速度。曲线H与工艺中阳极氧化电流密度的变化基本相一致。
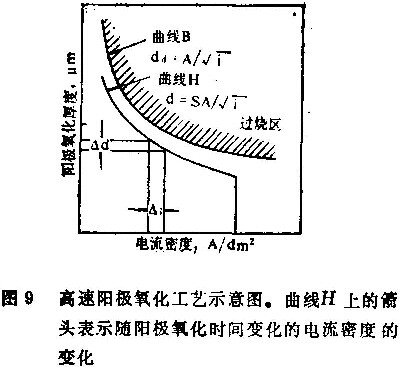
在这种新的高速阳极氧化工艺中,在厚度达到临界曲线B之前,在直流电阳极氧化的情况下,铝试样从一开始到to止,一直受到阳极化处理。然后阳极氧化电流密度随时间沿着曲线H下降。曲线H由下式给出:
在乙二酸槽液中:
d= SBo/i (13)
在硫酸槽液中:
d= SBs/i0.5 (14)
式中S是工艺安全系数,它的取值范围为0
在生产中,阳极氧化电流密度和氧化膜厚度的时间参数,可用公式(13)、(14)和(7)进行数学计算。下列公式(15)~(22)可供计算用。
阳极电流密度的变化:
在乙二酸槽液中:
当0
t>to,i=io/[l+ 2Kio2(t - to)/SBo] (16)
在硫酸槽液中:
当o
t>to,i=io/[1+ 3Kio1.3(t - to)/SBo]0.07 (18)
阳极氧化膜的生成:
在乙二酸槽液中:
当0
t>to,d(th)=SBo[1+ 2Kio2(t- to)/SBo]0.5io (20)
在硫酸槽液中:
当0
d(th)= SBs[1+3Kio0.5(t-to)/SBs]0.57/ io0.5 (22)
在上述公式中最初阳极氧化时间to,可由公式(7)、 (13)和(14)的联立求得:
在乙二酸槽液中:
to= SBo/Ki (23)
在硫酸槽液中:
to= SBs/Kio1.5 (24)
公式(15)、(16)、(17)和(18)决定的阳极电流的控制可由一个与微型计算机系统相联接的装置执行。当输入烧熔常数B、最初电流密度to、氧化膜形成常数K、安全系数S以及所需要形成的氧化膜厚度d(th)的数值后,阳极氧化就自动进行。
在高速阳极氧化中,电流密度和槽液电压的变化如图10所示。在这些试验中,按照下列条件阳极氧化:i= 20安培/分米3,Bs=530,K=0.42,S=0.5~0.9。有趣的是,尽管在最初阳极氧化时刻,电流密度大幅度地下降,但是槽液电压继续随时间而增大。
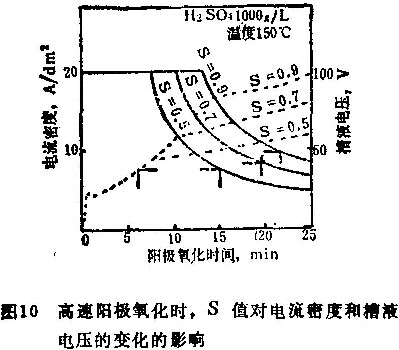
五、极限厚度
采用了高速阳极氧化工艺,由于铝表面的阳极氧化膜是在最高速度下形成的,所以可清楚地看到,在达到完全溶解所需要的时间ts以前,采用这种工艺可形成最厚的阳极氧化膜。
图11是采用高速阳极氧化工艺所形成的氧化膜极限厚度示意图。由于氧化膜是在处理初期形成的,当时间达到to以后,厚度开始迅速减小,如曲线ts-D所示,氧化膜有一个峰值厚度d1。
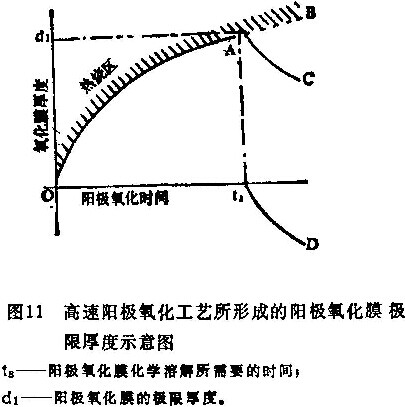
因此把ts代入公式(20)和(22),就得到了阳极氧化膜的极限厚度dcrjt:
在乙二酸槽液中:
dcrit= SBo[1+2Kio2(ts - to)/SBo]/io (25)
在硫酸槽液中:
dcrit=SBo[1+3Kio1.5(ts-to)/SBo]/io0.5 (26)
为了估算dcrit,必需知道处理过程中B值的变化与槽液成分、温度、搅拌情况以及铝材的成分的关系。换句话说,就是在阳极氧化过程中,在避免烧熔的情况下,只有采取合适的工艺才能获得厚的氧化膜。
为了证实这个理论分析,使用微型计算机系统控制装置,在乙二酸和硫酸槽液中做了一些实验。
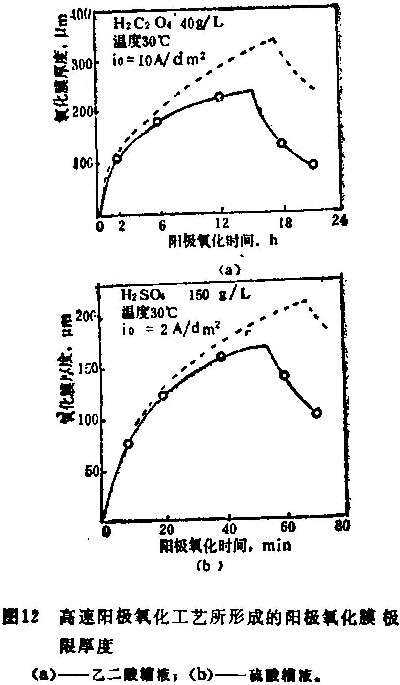
图12表示高速阳极氧化过程中氧化膜厚度的变化。在这些试验中,使用下列数值:
在乙二酸槽液中:
Bo =330; io=10安培/分米3,
K= 0.3; S=0.6
在硫酸槽液中:
Bs= 490; io=20安培/分米3;
K= 0.3; S=0.6
如图12所示,氧化膜厚度随时间增大,在时间ts时达到最大值;然后,由于氧化膜迅速溶解到槽液中而变薄。根据本工艺原理,在初期氧化膜是随着高电流密度的升高而迅速形成的。极限厚度值之所以比理论值小,是由于粉化现象和温度升高引起的。
六、所获得的最大厚度氧化膜的比较
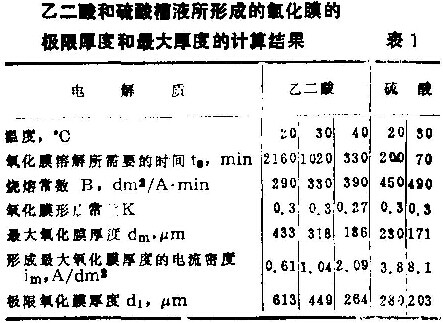
表1列出了在乙二酸和硫酸槽液中直流电高速阳极氧化所获得的氧化膜的最大厚度。从这些理论值中清楚地看到,就最大厚度和极限厚度来说,使用乙二酸槽液所获得的阳极氧化膜比使用硫酸槽液所获得的阳极氧化膜要厚。由于实际得到的氧化膜厚度值比理论厚度值低,所以在40克/升、20℃的乙二酸槽液中,实际的氧化膜厚度大约为400微米。
七、总结
本文阐明了关于在阳极氧化中,由于化学溶解和烧熔现象所控制的铝阳极氧化膜极限厚度的理论条件。应该注意到,所列的厚度值仪仅是例子。
根据这些研究,通过试验可确定实际极限厚度,因而,可以做出估算,氧化膜厚度极限值大约为600微米。

